AG Makrophagen (Bruns)
- Tumor-assoziierte Makrophagen
- Antikörpertherapie
- Multiples Myelom
Forschungsschwerpunkte
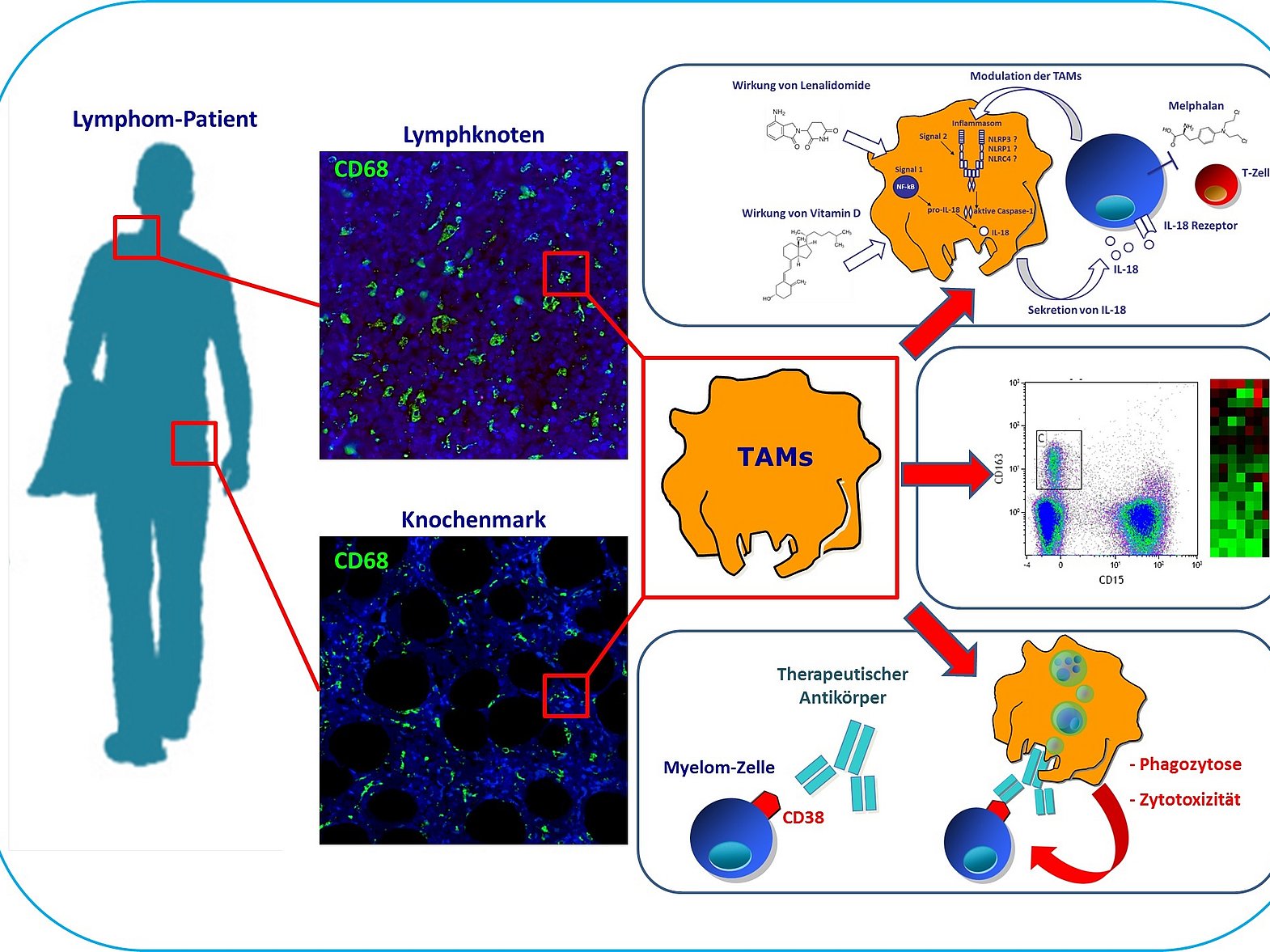
Bei den meisten Tumorentitäten besteht das Tumormikromilieu zu einem großen Teil aus Makrophagen. Obwohl Makrophagen prinzipiell in der Lage sind, Tumorzellen zu eliminieren und bedeutende Effektorzellen für Antikörpertherapien sind, stellt die Makrophagen-Infiltration bei den meisten Tumorerkrankungen paradoxerweise einen ungünstigen prognostischen Faktor dar. Im Zentrum der Projekte unserer Arbeitsgruppe steht daher eine umfassende funktionelle und molekulare Analyse des Tumormikromilieus, insbesondere der Tumor-assoziierten Makrophagen (TAMs), und die Identifizierung und Modulierung potenzieller therapeutischer Target-Strukturen. Unser langfristiges Ziel ist das spezifische Targeting bzw. die Modulation des Tumormikromilieus zur Verstärkung der Effektivität von immuntherapeutischen Strategien bei hochmalignen Lymphomen.
Labormitarbeiter
PD Dr. rer. nat. Heiko Bruns, Arbeitsgruppenleiter
Vievien Reinecke, PhD student
Johannes Berges, PhD student
Katrin Bitterer, MTA
Magdalena Leffler, MTA
Gina Nusser, PhD student
Dr. Christopher Lischer (PostDoc)
Aktuelle Projekte
- Effektor-Funktionen von TAMs bei hochmalignen Lymphomen
- Wirkung von immunmodulierenden Substanzen auf das Tumormikromilieu
- Transdifferenzierung von malignen B-Zellen in Makrophagen
Methoden
- Durchflusszytometrie
- ELISA
- Quantitative RT-PCR
- Westernblot
- Konfokale Mikroskopie
- Chromatin-Immunpräzipitation
- Isolation von Mikrovesikeln mittels Ultrazentrifugation
- Untersuchung von TAMs in verschiedenen Mausmodellen
Kollaborationen intern
- Maike Büttner, Pathologisches Institut
- Markus Hoffmann, Medizinische Klinik 3
- Diana Dudziak, Hautklinik
- Sven Krappmann, Medizinische Mikrobiologie
Kollaborationen extern
- Fabian Beier, Medizinische Klinik IV, Universitätsklinikum RWTH Aachen
- Michael Hundemer, Klinik für Hämatologie, Onkologie, Rheumatologie, Universitätsklinikum Heidelberg
- Stefano Rigcagno, Department of Biosciences, Universität Mailand, Italien
- Thomas Graf, Centre for Genomic Regulation, Barcelona, Spanien
- Jan Krönke, Medizinische Klinik III, Universitätsklinikum Ulm
- Steffen Stenger, Medizinische Mikrobiologie, Universitätsklinikum Ulm
- Robert Zeiser, Klinik für Innere Medizin I, Hämatologie, Onkologie und Stammzelltransplantation Universitätsklinikum Freiburg
Ausgewählte Publikationen
Daniel Hofbauer, Dimitrios Mougiakakos, Luca Broggini, Mario Zaiss, Maike Büttner-Herold, Christian Bach, Bernd Spriewald, Frank Neumann, Savita Bisht, Jens Nolting, Robert Zeiser, Shaima’a Hamarsheh, Martin Eberhardt, Julio Vera, Cristina Visentin, Chiara Maria Giulia De Luca, Fabio Moda, Stefan Haskamp, Cindy Flamann, Martin Böttcher, Katrin Bitterer, Simon Völkl, Andreas Mackensen, Stefano Ricagno, and Heiko Bruns. (2021). β2-microglobulin - a trigger for NLRP3 inflammasome activation in tumor-associated macrophages promoting multiple myeloma progression.
Immunity. 54(8):1772-1787.
The regulatory IKZF1-IRF4/IRF5 axis controls polarization of myeloma-associated macrophages. Dimitrios Mougiakakos, Christian Bach, Martin Böttcher, Fabian Beier, Linda Röhner, Andrej Stoll, Michael Rehli, Claudia Gebhard4, Christopher Lischer, Martin Eberhardt, Julio Vera, Maike Büttner-Herold, Katrin Bitterer, Heidi Balzer, Magdalena Leffler, Simon Jitschin, Michael Hundemer, Mohamed H. S. Awwad, Martin Busch, Steffen Stenger, Simon Voelkl, Christian Schütz, Jan Krönke, Andreas Mackensen, and Heiko Bruns.
Cancer Immunol Res. 2021 Mar;9(3):265-278
Bruns, H., Buttner, M., Fabri, M., Mougiakakos, D., Bittenbring, J. T., Hoffmann, M. H., Beier, F., Pasemann, S.,Jitschin, R., Hofmann, A. D., Neumann, F., Daniel, C., Maurberger, A., Kempkes, B., Amann, K., Mackensen, A. and Gerbitz, A., Vitamin D-dependent induction of cathelicidin in human macrophages results in cytotoxicity against high-grade B cell lymphoma. Sci. Transl. Med. (2015)
Bruns, H., Bessell, C., Varela, J. C., Haupt, C., Fang, J., Pasemann, S., Mackensen, A., Oelke, M., Schneck, J. P. and Schutz, C., CD47 Enhances In Vivo Functionality of Artificial Antigen-Presenting Cells. Clin. Cancer Res. (2015)
Bruns H, Stegelmann F, Fabri M, Döhner K, van Zandbergen G, Wagner M, Skinner M,. Modlin RL and Stenger S. Abelson Tyrosine Kinase Controls Phagosomal Acidification Required for Killing of Mycobacterium tuberculosis in Human Macrophages. J Immunol. (2012)
Fabri M., S. Stenger, D.-M. Shin, J.-M. Yuk, P. T. Liu, S. Realegeno, H.-M. Lee, S. R. Krutzik, M. Schenk, P. A. Sieling, R. Teles, D. Montoya, S. S. Iyer, Bruns H, D. M. Lewinsohn, B. W. Hollis,M. Hewison, J. S. Adams, A. Steinmeyer, U. Zügel, G. Cheng, E.-K. Jo, B. R. Bloom, R. L. Modlin. Vitamin D is required for IFN-gamma-mediated antimicrobial activity of human macrophages. Sci. Transl. Med. (2011)
Bruns H, Meinken C, Schauenberg P, Härter G, Kern P, Modlin R, Antoni C, Stenger S. Anti-TNF immunotherapy reduces CD8+T cell mediated antimicrobial activity against Mycobacterium tuberculosis in humans. J. Clin. Invest (2009)
Pressemitteilungen
Vitamin-D-Hilfe-im-Kampf-gegen-Krebs (Interview im Deutschlandfunkt)
Verwandlungskünstler im Fokus der Forschung